Interview:上田実先生インタビュー(2/3)
上田実:1949年大阪府生まれ。東京医科歯科大学歯学部卒業、名古屋大学大学院医学研究科修了。再生医療の第一人者として知られ、幹細胞の分泌する生理活性物質が組織再生の主役であることを発見。それを含有する培養上清(ばいようじょうせい)液を用いた治療により日本再生医療学会ジョンソン&ジョンソン賞等を受賞。研究論文数は600以上、臨床症例数は100例を超える。名古屋大学医学部名誉教授。国立研究開発法人日本医療研究開発機構(AMED)評価委員長、文部科学省新学術領域研究専門委員会審査員、日本学術振興会科学研究費委員会専門委員、東京大学・ベルゲン大学・ワシントン大学客員教授、その他多数を歴任。

「医学の目的は患者を治すこと」。上田先生の唯一のテーゼだ。我々文学者も生身の人として、癌、アトピー、花粉症など何かしらの患者もしくはその家族であろう。上田先生の言葉は、その患者一般の思いから一歩もずれることがない。インタビューでは、アカデミズムを超越した上田先生の明確な現実感覚と患者への共感性、だからこその世界初ALS症状緩和、末期癌の進行停止、アルツハイマーの回復、重度の糖尿病の改善等へ至った“機序”が明らかにされる。そしてそれを生んだのは、他でもない“芸術への志向”をくぐった“人への愛惜の念”でもある。
小原眞紀子
■日本人ノーベル賞受賞の明暗■
小原 再生医療に関心を寄せる人は多いですが、そもそもどのように発展・分岐してきたのか、その結果としての期待できるものと怪しいものを、より具体的にお聞かせください。
上田 再生医療を広義にとらえれば、インカ帝国時代から金属の人工歯根などで歯の再生が行われていましたが、近・現代の再生医療は幹細胞医療という一つの研究分野として成立しました。
小原 現実的な基本はiPSとか横文字のものじゃなくて、あくまで「幹細胞」ですね。
上田 幹細胞治療について簡単に説明すると、例えば肝臓が機能しない状態になっている場合に、外部から幹細胞を補充すると、その未分化の幹細胞が肝臓に集まって、分化し、古い肝臓の細胞と置き換わって肝臓を再生する。
小原 なるほど。すごいですね。
上田 ただこれはあくまで希望的なシナリオで、基になっているのは白血病の治療で行われる骨髄移植でした。いったん死滅した骨髄に健全な造血幹細胞を補充する。すると骨髄の中に集まって正常な骨髄が再生して血液が再び造られるようになる。それは他人の骨髄液(*)でいいのです。*造血幹細胞を含む血液
小原 それで実際、白血病が治癒した方もたくさんいらっしゃいますね。
上田 骨髄移植がうまくいっていましたので、肝臓や膵臓、脳などでも同じことをやれば再生するだろうと考えられたのです。これが再生医療の第一期と言っていいかもしれません。ところが実際にやってみると、期待したほど効果が上がらなかった。いまから思えばこの時点で幹細胞治療の効果をきちんと検証しておけばよかったと思います。
小原 シナリオ通りにいかなかった…。
上田 さらに困った事態も起きました。日本には「自由診療」という制度があります。患者の同意があれば標準的ではない治療も可能になる。この自由診療の枠内で幹細胞移植を行ったクリニックで死亡例が出たのです。そこで、幹細胞移植はそう簡単ではないぞ、ということになってきて、日本再生医療学会などが中心になってこの治療を規制する動きになった。

小原 クリニックなどの自由裁量が効かなくなったのですか。
上田 そうです。根拠のない治療が行われないように、治療内容を審査委員会に申請し妥当性を評価する制度ができたのです。そして規制する代わりに、再生医療の産業化に向けて、「特急券」を発行したらどうか、という話になりました。届けを出して治験をやって、再生医療を産業化するなら条件付き早期承認を与えましょう、という流れです。飴と鞭を同時に与えるかたちで法律を作ったのが再生医療新法(再生医療等の安全性確保等に関する法律)です。
小原 幹細胞移植の効果をきちんと検証する前に制度化のみが進んだのですね。
上田 同じころ、山中先生がiPS細胞を使えばどんな幹細胞でも作れるという技術を発見されたわけです。この技術を使えば再生医療はぐっと進歩しますから、その路線で行こう、ということになったわけですね。
小原 その思想が行き渡った、と。
上田 その結果、幹細胞移植に対する本質的な検証が置き去りになってしまった。さらに山中先生がノーベル賞を受賞されたことで、再生医療=幹細胞移植という路線が確定的になった。しかしもうノーベル賞受賞から十年近く経ちますが、実際あの研究で何人の患者さんが治ったのかわからない。
小原 わたくしは寡聞にして存じません…。
上田 臨床試験に関する詳しいデータも一般に公表されていません。ただ十年間で一一〇〇億円の研究費が投入されているわけですから、ある程度の成果が出ないとなかなか難しいことになります。
小原 素人の印象に過ぎませんが、山中先生は近年、苦悩を深めておられるようにお見受けしています。
上田 もちろんiPS細胞の研究は重要です。が、iPS研究だけに研究費が集中したら、若い研究者の独創的な仕事にお金が回らないというのは問題でしょう。そこには近い将来の、超ノーベル賞級の研究が潜んでいるかもしれない。
小原 可能性は十分にありそうです。ようは予算のバランスの問題ですね。
■ステミラック注®の諸問題■
上田 幹細胞治療での死亡事故を契機に規制と早期承認制度を作るという流れに乗ったのがステミラック注®です。医療機器メーカーのニプロと札幌医科大が共同開発した幹細胞薬です。これが早期承認され販売が認められた。
小原 脊椎損傷を治療できる、というものですね、NHKが特集番組を放送して、点滴注射をしたら次の日に歩き出したという奇蹟的な光景を見ました。
上田 それに対してネイチャー誌が批判的なコメントを出した。例えば治験の症例数が13例と少ない、コントロール(比較対照)を作っていない、論文もない、科学的基盤も矛盾している、などということを指摘したうえで日本の早期承認制度を批判したわけです。つまり治療効果がはっきりしていないのに国がお墨付きを与えていいのか、ということです。
小原 ネイチャー誌ですよね。それは世界的な大恥です…。
上田 さらに問題なのは、承認後の追加的な治験は有償で行ってよい、つまり患者さんに金銭的な負担をかけてもよいということになっている。
小原 ステミラック注®の治療を受けた患者さんのYouTube動画も見ました。二、三百万円を出して治療を受けたんですが、自分には効果がなかった、といった内容でした。
上田 本来、臨床治験というのは効果があるかどうかを検証するためのもので、その段階でお金を取るということは、非常に難しい問題を孕んでいます。
小原 その方は効果がなかったので、二回目はできない、という動画でした。もちろん、よくなった患者さんもいらっしゃるんでしょうが。
上田 治療が効いたということであれば、少々金額が大きくても許されるところもあるかもしれませんが、効かないとなるといささか問題です。
小原 そういうところを政府の施策で丁寧に補完しなければなりませんよね。
上田 効果が不確かな医療を、病気で困っている患者さんに有償で施すわけですから、その前の臨床研究(無償)でよほど確信がなくてはならない。確かに患者さんから治療費をいただきながら、臨床治験ができるのですから企業にとっては大きなメリットになります。再生医療の産業化を促進するにはとてもいい制度ですが、反対に藁にも縋る思いで参加した患者さんにとっては酷な制度ともいえるのです。われわれが培養上清によるALSの治療を始めたときは、この葛藤から逃れるという意味もあって、臨床試験は無償でやることに決めたのです。一家の大黒柱の方がALSになられたら家計は崩壊して治療費は捻出できませんからね。金銭的な支援をしてくださる方も、たいていはいませんし、そんな境遇の方たちから多額のお金を取るのはどうか、と普通の神経だったら思いますよね。
小原 脊椎損傷の患者さんのご家庭だって、ご事情は同じはずですけど…。
上田 ともあれステミラック注®の開発者の方々は、幹細胞が脊椎に集まって再生する、とおっしゃっています。しかしステミラック注®に関しては、市民団体が厚生労働省に対し承認を取り消し、臨床試験に戻して有効性・安全性を再確認するよう要望書を出しています。
■その他の幹細胞移植の問題点■
上田 脳の再生医療の場合、脳梗塞なんかですけど、頭蓋骨に穴を開けて幹細胞を直接針で脳の中に注入することも行われています。これはアメリカで治験が行われましたが残念ながら効果が証明できなかった。
小原 幹細胞移植では、頭蓋骨に穴を開けるとか、大変な処置のわりに効果が見込めないのですね。
上田 心臓に関しては、大阪大学のグループが細胞シートを作って、それを心臓に貼り付けると心機能を再生できる、という治療法を発表されました。治験も行われ、実際に効果があったケースも報告されています。第一号の早期承認制度も適用されたのですが、これに関してもネイチャー誌が噛みついています。胸郭を開くなどすごく大変な手術ですし、かえって悪くなってしまった例もあったと聞いています。二重盲検試験をしていないとか、ゴタゴタしています。ステミラックも細胞シートも、同じような顛末です。
小原 細胞シートは保険適用になっているので、効果が高いと思っていました。そうするとその承認も「政治的」なものだったのですかね…。アベノミクスの第三の矢、つまりイノベイションと規制改革の目玉として再生医療の産業化が強引に推進されてその弊害がでた、という噂もあります。
上田 あおりを食ったのがMUSE細胞だったのかもしれません。MUSE細胞の実用化を目指していた三菱ケミカルホールディングスと子会社が二〇二二年の早期承認小原 突然のことで、驚きますよね。
上田 詳しい事情はわかりませんが、MUSE細胞は早期承認を受けようとしていたのですが、それが通ったとしてもネイチャー誌が制度自体を疑問視しているなら、国際社会には受け入れられない、もう一回治験をやり直さなければならないと会社が判断した可能性はあります。MUSE細胞が話題になったのは、たった一年くらいの間でした。
小原 三菱ケミカルの株価はあの時期、すごく上がっていました。これだから製薬会社の株は危ない、って言われる(笑)。
上田 個人的にはMUSE細胞に限らず、幹細胞治療は費用対効果の点からみて難しいと感じていました。
小原 幹細胞移植、全滅ですか…。
上田 肝臓の場合は、新潟大学のグループが研究しておられたんですが、患者さんの自家細胞を使う治療でした。肝硬変の患者さんに全身麻酔をかけて骨髄から細胞を採って、それを増やして再移植する方法です。ただ全身麻酔は、身体にものすごく負担がかかります。特に肝臓が悪い患者さんにとってはそうです。先進医療の臨床試験ですから仕方がない面はありますが、まあ数々の問題があります。
小原 不死化細胞、というものはどうなんでしょう。
上田 わたしたちは不死化細胞は使っていません。不死化細胞は動物実験に使うべきものであって、人間に使うべきではないと考えていましたから。その意味ではiPS細胞に似ているところがあって、遺伝子を操作していますから。

小原 遺伝子操作が、すなわち危険なのですか。
上田 不死化細胞を作るときに使ったがん遺伝子の断片が、エクソソームに乗って、培養上清の中に出てきてしまう。遺伝子操作された幹細胞が放出するものですね。それで近くに正常細胞があると、その遺伝子を取り込んでしまうおそれがある。多くの研究者がこの点を懸念しています(**)。
**:第1回エクソソームを含む細胞外小胞(EV)を利用した治療用製剤に関する専門部会議事録
小原 よく聞く「iPS細胞の癌化リスク」というのに似てますね。
上田 不死化細胞の作成は、がん遺伝子組み込み法だけではなく発がんウイルスの一部、細胞の形質転換に関係する遺伝子を導入したり、サルの発がんウイルス(SV40)を導入する方法もあります。問題は、方法はなんであれ細胞が不死化した場合、染色体構造が大きく変化してしまうことです。こうした不死化細胞が放出する生理活性物質が正常細胞に入ったときに、どうなるかわからないのです。
小原 新型コロナのmRNAワクチンとは違って、操作された遺伝子が体内に残ってしまう。不死化細胞もiPS細胞も実験用で、人体に戻すべきものではないのですね。
上田 われわれの目的は患者さんを安全に治すことですから、リスクの高い治療には慎重にならざるを得ない。患者さんを治すという名目を免罪符にして、インチキな医療もはびこっています。きちんとしたデータを出してもらうことで、良貨が悪貨を駆逐してくれるとよいと思います。声の大きい人の意見・治療法が正しいわけではないのです。
■国のサポート・補助■
小原 お話をうかがうと、この短い期間にも研究が進み、その結果として再生医療の流れが大きく変わっています。国からもらう研究費などは、その目的を途中で変えることはできるのですか。
上田 五年間の研究費として何億円かもらったとしますよね。そうすると、最初に申請した研究目的を変えることは原則できません。途中で新しい研究成果が入ってきたり、あるいは新しい発見によって当初の予想とは違う方向に進みそうだと気づいたりしたら、その変更を申請しなければなりません。つまり申請し直さなければならない。でも行政の側には、それでOKと言ってくれる柔軟性はないですね。
小原 そうでしょうね(笑)。
上田 研究は日進月歩ですから、以前言っていたことや、以前のスタンスと違う方向に研究が進むのはむしろ当たり前です。それこそ癌遺伝子やウイルスがエクソソームに乗って、人体に癌遺伝子が取り込まれるリスクがあるじゃないか、とわかっても、文科省と厚生労働省は隣同士の省庁なのに、ぜんぜん違う見解になってしまうことがままあるんです。小回りが利かない。だから研究者は「当初申請した研究をやっています」と言いながら、密かに新しい研究を並行させたりします。
小原 ITの世界では「五年は永遠」と言います。再生医療も二、三年でどんどん変わっていくような研究領域なのに、五年単位の補助金制度で変更も認めないのでは、日本での研究は行き詰ってしまいます。
上田 結論めいたことを言いますと、再生医療に関する限り日本は非常にまずい戦略を採ったと思いますね。幹細胞移植に固執しすぎた。ステム・セル・フリーセラピー(幹細胞を使用しない治療)が、世界の研究の主流になりつつあるのに相変わらず幹細胞全盛ですから。その結果、先進国のなかで日本が一番遅れてしまった。
小原 国の補助が進まないなら、例えば培養上清を使った化粧品を開発して、その利益を難病の治療に当てることはできないのですか。いま出回っている怪しい化粧品でなくて、ちゃんと効果のある…(わたし買いますし!)。
上田 皆さん、それを考えるんですよ。培養上清を使った化粧品(笑)。製薬会社の方たちは、ALSなどの難病は採算をとるのが非常に難しいと考えています。患者数が少なくおまけに治療薬の開発のめどがたっていない。決定的なのは培養上清やエクソソームを使ったステム・セル・フリー治療にはまだ決まった基準やルールがない。
小原 国の制度が不全だとすると、製薬会社も乗り出しづらくなりますよね。
上田 国内の製薬会社だけでなく、海外での承認という方法もあります。たとえば東欧諸国などではそもそも幹細胞治療の歴史が浅く、それだけに古い技術に固執することなくあっさりと新技術を受け入れてくれる可能性がある。要は安全に安く患者が治ればいい、という考えです。
サイトカイン、エクソソーム、成長因子や細胞外マトリックスのすべてが培養上清に含まれているなら培養上清を使いましょう、と。
小原 細胞外マトリックスというのは抽象概念ではなく、具体的な物質なんですか。
上田 物質です。プロテオグリカン、ヒアルロン酸とかコラーゲンも含まれていますし、DNAのチェーンがもっと短く切られた物質も無数に存在しています。それらもステム・セル・フリーセラピーと呼ぶようになりました。この研究に関してはシンガポールのグループが一番進んでいます。彼らと個人的に話していると、「幹細胞治療はもう時代遅れで、危険なわりには効果がない。グッバイ・ステム・セル!」という言葉が盛んに出てきます。
■原材料と安全性■
小原 そもそも培養上清は細胞を含まないわけですから、幹細胞治療と違って癌化はしない。さらに感染性も、アレルギー性もないのですね。
上田 そうです。癌化の可能性もなく、正規の製造工程で製造すれば感染性もアレルギー性も排除できます。ただルールがないので、怪しい業者がまだ野放しなんです。
小原 つまり「正規の製造工程」がきちんとなされているか、患者には確認が難しい…。
上田 幹細胞移植をする場合には、届出と審査制度があります。問題の早期承認制度もあります。培養上清は届出も規制もない。最近になってようやく議論がはじまったというのが実情です。培養上清の製造設備としてどういうものが求められているのかも、どういう基準をクリアしていたら製品として認めるのかも曖昧です。
小原 細胞が含まれない上澄み液である培養上清については、基準がないわけですね。
上田 あるとすれば、幹細胞治療にかけられた網(再生医療新法)が援用できるだろう、という程度の認識です。これは二〇二二年現在でもそうです。日本人は法律を重視しますから、ちゃんとした法的基準がない治療にはなるべく関わらないようにしよう、というのが多くの医薬品会社の姿勢です。
小原 リスクには皆、敏感ですからね。読者からも質問が来ると思うので、しつこくお尋ねしますが、上田先生のご研究で使われる培養上清はもちろん、同じものを使う提携クリニックでも、感染性やアレルギー性のリスクはない、と確認できているのですね。
上田 もちろんです。われわれは再生医療新法が培養上清治療にも適用されたものとして培養上清の製造を行っています。
小原 安心しました。ただ、そんな確かなものを使っている医療機関ばかりとはかぎらない。
上田 日本再生医療学会としては、現時点では培養上清やエクソソームの規制については、再生医療新法は細胞を使った医療のために作られた法律だから培養上清治療は対象外、という姿勢です。規制する法律がないわけですから、ある意味、やり放題の領域になっている。培養上清製品はたくさん出まわっていますが、どんな基準で作られているのかもわからない。どんな治療効果があるのかもわからない。外国製の製品もたくさん入っているときいています。
小原 そうするとJISマークのように、あるいは商標登録して、「これは安全な製品である」と一般の人にもわかる目印が必要になりますね。培養上清の治療薬といっても、これでなくてはダメなんだ、という基準がなければ混乱してしまいます。
上田 こうした状況なのでわたしたちは自主的にルールつくりに取りかかっています。これは大雑把な概念図ですが、細胞の培養方法だとか、細胞の起源や処理法だとか、元々の細胞を提供した方の年齢だとか、そういうことで培養上清の質が変動するのです。したがって条件を一定にしておかないと一定の基準の培養上清が出来ない。また培養上清の質と治療効果は一対一の関係で繋がっていますから、理論的には同じ培養方法で作った同じ培養上清でないと同じ治療結果が出ない、ということになります。
ですから、ひとことで「培養上清」と言われても、それが同じ効果を生むものかわからないわけです。「この方法で作った培養上清で、この結果が出たんだ」という一対一のデータがなければ、「効果があった」という言葉に意味がありません。リスクに関しても同じで、アメリカのネブラスカ州で、培養上清を使った治療で5名の敗血症が出ましたが、彼らの製造工程とわれわれのそれとは違うわけです。ですから「培養上清」を使うと感染症になる怖れがある、とはならない。早急に規制もしくは一定の基準を作る必要がありますね。
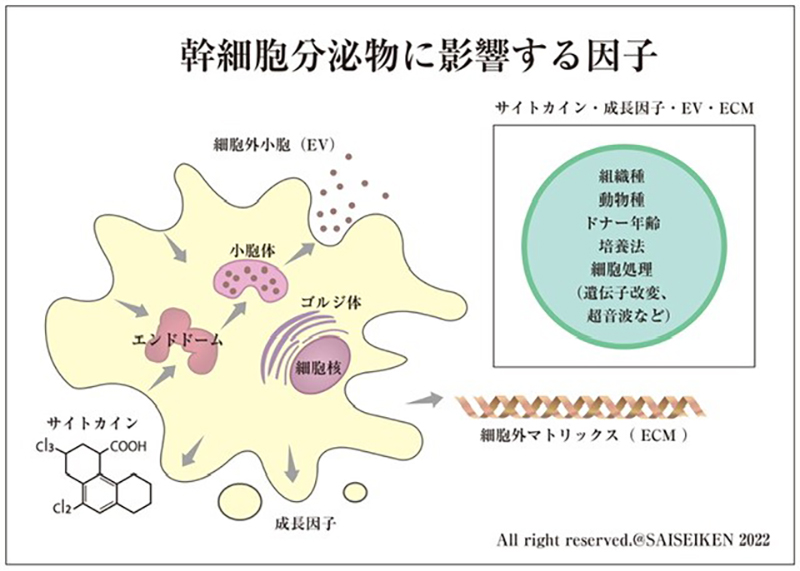
小原 「認定培養上清」ってハンコ作って、薬瓶に押しましょう(笑)。
上田 特定の疾患を治すためには、どの細胞種を、どのくらいの数を使って、どういう培養方法で、培養上清を作ったらいいのか基準があるはずです。臨床研究ははじまっています。あとは産業化にむけた制度の問題です。
小原 乳歯歯髄幹細胞が一番いいという話を、YouTubeか何かで聞きましたが。
上田 乳歯幹細胞が万能ではありません。疾患によります。神経系の再生やアレルギー疾患に関しては乳歯歯髄幹細胞がいいです。それ以外の、例えば腎臓や皮膚、骨、軟骨の治療になると、骨髄の幹細胞が効果的です。元になっている幹細胞の種類によって効果のある疾病が違うのです。一つの幹細胞で全部の疾病を治すという考えは間違いです。それには治療成績・エビデンスとのつきあわせを大事にしなければなりません。
小原 オールマイティに治療できる、と言う医療機関は、警戒した方がいいですね。
上田 すべて治せると言わずに、ある患者さんに対しては「ウチはその培養上清を使っていないので別の医療機関を紹介します」とか。
小原 一般の保険診療ではそれが当たり前ですが、自由診療で紹介はなさそうですね…。
上田 何でも効きますというのはムリがあります。効くなら効くで、エビデンスを論文などで公表してほしい。わたしたちは脂肪、臍帯、骨髄、歯髄の幹細胞の効果を比較して発表しています。その結果として、乳歯幹細胞はアレルギーと神経疾患によく効くことがわかったのです。
小原 アレルギーと神経疾患。炎症かな…。
上田 その理由として、神経再生を促進したりアレルギー反応を抑える鍵となるエクソソームやサイトカインの量が乳歯幹細胞由来の培養上清が一番多いことがわかりました。幹細胞にはそれぞれ特色が分かれています。乳歯の発生は脳と同じ起源です。両者は類似の特徴を持っていて類似のエクソソームやサイトカインを出している可能性が高い、と私は考えています。
小原 乳歯と脳の発生起源。位置的にも近いし、それはすごく面白いですね。
■培養上清と自由診療■
上田 培養上清治療は今のところ自由診療ですが、自由診療には必ずしも科学的裏付けのない治療もあります。
小原 エビデンスがあるものはどれかを明確に周知すれば、これを試してみたい、と患者さん側から主治医に申し出ることも考えられますね。
上田 新しい治療法の承認は、臨床治験を行い、国が承認し、企業が製薬化する、というコースのほかに、もう一つ方法があります。典型的なのは丸山ワクチンです。この薬は日本医科大学にいらした丸山千里先生が、院内に培養装置を作って製造したワクチンです。培養装置を作るためのお金、研究費などはゼリア新薬工業が提供しました。国は承認していませんから、未承認薬ですが患者さんの家族が日本医大に行って、主治医の共同研究のサインがある書類を見せると、丸山ワクチンを売ってくれるという仕組みです。承認薬と未承認薬の中間みたいな形ですが、製薬企業はそのシステムで利益を上げているわけですから、丸山ワクチンに関しては経済的には循環していると言えます。
ALSについて言うなら、われわれのところに来られた患者さんの主治医の方はとても協力的でした。ご本人ご家族が希望されるならなんでもやってみなさい、という姿勢でした。見方を変えれば、どこか匙をなげておられるような、でも何かあったらうちで面倒を見ます、という方が多かったです。その意味ではALSという疾患は特殊なのでしょう。
小原 一方で、癌には数えきれないほど様々な療法がありますね。
上田 癌に関してはNK細胞治療やリンパ療法も民間の自由診療で行われていますが、大学や公的病院のお医者さんは冷ややかですね。ちゃんとしたエビデンスがないですから。
■STAP細胞とiPS細胞■
小原 先生が兼任されている数多くの公的なお仕事には、論文の審査に関わるものもあるようにお見受けします。特に再生医療は注目されているだけに、いろいろな裏事情を見聞きされ、また思うところもおありではないですか。
上田 私の現職時代もっとも記憶に残っているエピソードとしてはSTAP細胞事件があります。新型万能細胞をめぐる論文捏造事件ですね。調べてみると、世界的な捏造事件は三つくらいあるんです。一つはヘンドリック・シェーン事件です。常温超伝導の超伝導転移温度の最高記録を塗り替えた大発見です。常温で作動する超伝導物質を見つけたという研究ですね。それが本当ならテクノロジーが大進化するわけで、一時期はノーベル賞級だと言われました。もう一つの有名な捏造事件は韓国のファン先生がヒトクローン株を見つけた、作ったという捏造事件です。三つ目が言うまでもなく小保方さんのSTAP細胞事件です。

小原 やはりSTAP細胞はなかった、ということでしょうか。
上田 STAP細胞事件は、最初のシェーン事件にとても似ています。シェーンも小保方さんも若い研究者です。まず若い研究者がほとんど奇蹟的と言っていいくらいの業績をあげる。そしてその分野において大物と言われる人がその発見にお墨付きを与える。STAP細胞事件の場合は、やはり再生医療分野における権威の先生方が、無名の小保方さんをバックアップして権威を与えた。
小原 元リケジョとしては、小保方さんを信じたかったです。ちょうどあの記者会見があった直後に日比谷線に乗っていて、オジサマ二人が乗車してこられた。そのうちの一人が本当に呆然とした顔つきで「僕はいまだに彼女が嘘を吐いていたとは、どうしても思えない」と言っていたんです。きっと理研の関係者だ、と思ってしまいました。そのぐらいのインパクトがあった。わたしもあの確信にみちた「STAP細胞はあります」が嘘だとは、いまだに思えません。
上田 理論的にはあり得るんですよ。理論的にはあるんだけど、理論と彼女が出したデータが乖離していた。科学の世界ではよくあることです。
小原 よくあること…。そうですか。
上田 理論と実際との乖離と言えば、iPS細胞もそうです。iPS細胞では確かに、ES細胞とか受精卵に近いポテンシャルを持った万能細胞を作れるんだけれども、それを一気に患者を対象とした再生医療に使おうとするものだから、さまざまな混乱が起こる。
小原 山中先生はiPS細胞研究所をお辞めになりましたね。
上田 理研・先端医療センターの高橋政代先生も、「網膜色素変性症の治療の可能性が生まれた」と発表なさいましたが、やはりお辞めになってしまった。どういう臨床成果があったのか。果たしてiPS細胞から作った細胞を移植して成果が上がったのか。
小原 かなりの額の税金が投入されていますから、すべて公表していただきたいです。
上田 iPS細胞研究は、患者さんにとっては大きな希望でした。加えて沈没しかけている日本を再浮上させるための重要なイノベーションとして国からお墨付きを与えられています。最重要研究として位置付けられているわけですが、すぐ効果が出るようなものではないようですね。
小原 わたしたち一般人はいわば患者の立場ですし、難病の患者さんには時間がありません。すごく乱暴な言い方をしますと、患者にとっては今現在、STAP細胞もiPS細胞も大差ありません。iPS細胞がいつの日か素晴らしい治療をもたらしてくれるとしても、それまで生き延びさせてくれるものは何なのか。マスコミでも口コミでも、それを広めて、その盛り上がりで政府を動かす必要があります。
上田 それを実現するために、わたしどももプロ中のプロが書いた論文を、もう少しわかりやすく、噛み砕いて解説する必要があります。もちろん絵に描いた餅ではいけないわけで、エビデンスも揃えなければなりません。そういうことができればいいな、と思っています。その端緒になったのがALSの臨床試験です。
(中編 了)
〈次回、下編「STAP細胞事件の真相」、「科学と文学あるいは深層心理」についてお届けします。〉
患者様等の培養上清治療に関するお問い合わせ先:
株式会社 再生医学研究所 https://saisei-ken.com/contact/
 縦書きでもお読みいただけます。左のボタンをクリックしてファイルを表示させてください。
縦書きでもお読みいただけます。左のボタンをクリックしてファイルを表示させてください。
■ 上田実先生の本 ■
■ 金魚屋の本 ■
■ 金魚屋 BOOK Café ■
■ 金魚屋 BOOK SHOP ■






